La Commission européenne accorde davantage de temps aux entreprises pour leur permettre d'appliquer le règlement DM-DIV relatif aux dispositifs médicaux de diagnostic in vitro, sous certaines conditions. L'objectif est de garantir leur disponibilité et une transparence accrue.
...
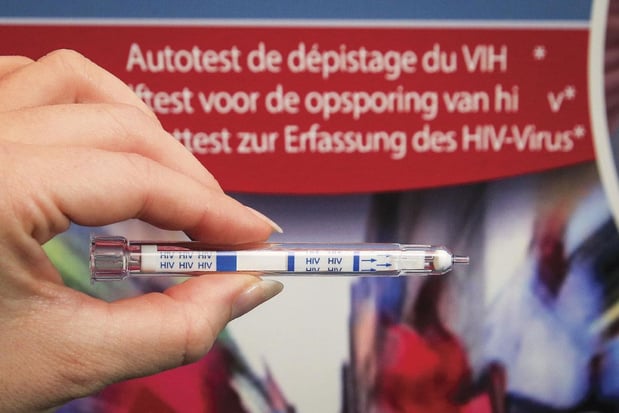
Les dispositifs médicaux de diagnostic in vitro sont des tests de dépistage du VIH, des tests de grossesse ou de dépistage du Covid-19. On estime qu'environ 70% des décisions cliniques sont prises à l'aide de ce type de dispositifs. Le règlement, applicable depuis mai 2022, vise à moderniser et à améliorer le cadre de l'UE pour ces produits afin de garantir leur sécurité pour les patients."Toutefois, les données disponibles montrent qu'à l'heure actuelle, un nombre considérable de dispositifs de diagnostic in vitro actuellement sur le marché ne sont pas encore conformes aux nouvelles règles et n'ont pas été remplacés par de nouveaux dispositifs. La situation est particulièrement critique pour les dispositifs de diagnostic in vitro à haut risque, qui sont utilisés, par exemple, pour rechercher des infections dans le sang ou les organes provenant de donateurs. Afin d'améliorer la disponibilité de ces dispositifs essentiels, la proposition présentée le 23 janvier accorde, sous certaines conditions, davantage de temps aux fabricants pour leur permettre d'appliquer les nouvelles règles sans compromettre les exigences de sécurité", précise la Commission européenne en soulignant que de nombreux fabricants de ce type de dispositifs sont des petites et moyennes entreprises.Ces règles s'appliqueraient à partir du 26 mai 2025 pour les dispositifs de diagnostic in vitro à haut risque et à partir du 26 mai 2027 pour les dispositifs de diagnostic in vitro à faible risque. Le délai supplémentaire accordé aux entreprises dépend du type de dispositif:-ceux de classe D, présentant un risque élevé pour l'individu et pour la santé publique, tels que les tests de dépistage du VIH ou de l'hépatite, jouiraient d'une période de transition jusqu'en décembre 2027;-ceux de classe C, présentant un risque élevé pour l'individu et/ou un risque modéré pour la santé publique, tels que les tests de dépistage du cancer, jouiraient d'une période de transition jusqu'en décembre 2028;-ceux de classe B, présentant un risque inférieur, qui comprennent notamment les tests de grossesse et les dispositifs stériles de classe A tels que les tubes de prélèvements sanguins, jouiraient d'une période de transition jusqu'en décembre 2029.Notification obligatoire et transparence accrueLa proposition impose également aux fabricants de notifier au préalable s'ils prévoient l'interruption de la fourniture de dispositifs médicaux de diagnostic in vitro ou d'autres dispositifs médicaux, afin de donner plus de temps aux États membres pour prendre des mesures visant à assurer les soins aux patients.Par ailleurs, la Commission propose d'accélérer le lancement des composantes d'Eudamed qui sont déjà achevées et de rendre l'utilisation de cette base de données obligatoire plus tôt (à partir de la fin 2025), ce qu'elle juge essentiel pour la mise en oeuvre efficace et efficiente du règlement relatif aux dispositifs médicaux et du règlement relatif aux dispositifs médicaux de diagnostic in vitro. Cette proposition doit à présent être soumise au Parlement européen et au Conseil pour adoption.L'Ordre français des pharmaciens rappelle que "l'application des règlements européens sur les DM et les DM-DIV a déjà fait l'objet de plusieurs reports, d'abord du fait de la crise sanitaire Covid-19, puis par deux fois (en janvier 2022 et en mars 2023) pour éviter la pénurie face aux difficultés rencontrées par les fabricants et organismes notifiés dans la mise en oeuvre des règlements".